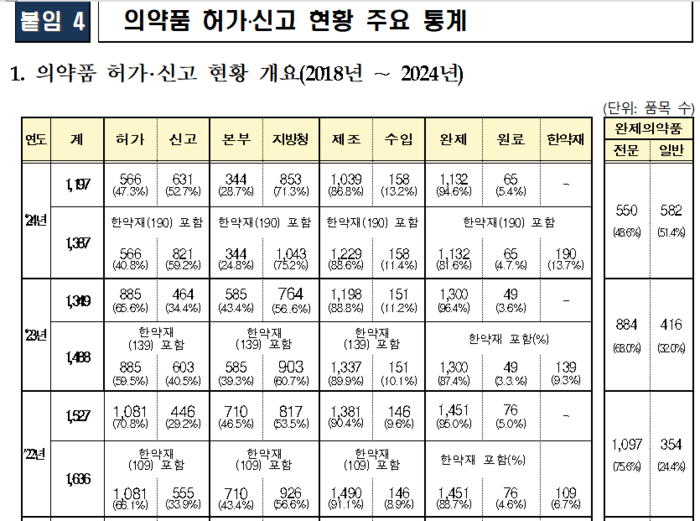
지난해 국내에 허가·신고된 의약품은 총 1197개 품목으로 나타났다. 희귀의약품 허가 증가세, 순환계용약 비중 확대, 바이오시밀러 역대 최다 허가 등의 특성이 나타났다.
식품의약품안전처는 29일 이 같은 내용의 의약품, 의약외품, 의료기기 허가·인증·신고 현황보고서를 발간했다.
지난해 희귀의약품은 2023년보다 2개 품목이 증가한 총 26개 성분·39개 품목이 허가됐다. 이 중 급성 골수성 백혈병 치료제 등 항악성종양제가 16개 품목으로 가장 많았다.
지난해 동등생물의약품(바이오시밀러)은 총 10개 성분·18개 품목이 허가됐다. 지난 2012년 처음으로 바이오시밀러 품목을 허가한 이래 가장 많은 수치다. 이 중 절반 이상인 7개 성분·13개 품목이 국내에서 개발됐다. 지난해까지 허가된 총 72개 품목(35개 성분) 중 52개 품목(24개 성분)이 국내 개발 품목이었다. 비율로는 약 72%다.
식약처는 특허 만료를 앞둔 원개발사의 품목이 다수 있어, 국내 기업의 동등생물의약품 개발이 활발할 것으로 기대했다.
지난해 허가·신고 의약품 총 1197개 품목 중 은행엽건조엑스 등을 주성분으로 하는 순환계용약이 총 161개 품목으로 가장 많았다. 해열·진통·소염제와 당뇨병용제가 각각 146개 품목, 127개 품목으로 뒤를 이었다.
지난해 제네릭의약품 등 허가·신고 품목 수는 2023년 802개 품목에 비해 5.3% 증가한 총 845개 품목이었다. 2021년 7월부터 동일한 임상시험자료를 다른 품목에 사용할 수 있는 횟수를 3회로 제한한 효과로 추정된다.
지난해 의약외품은 총 659품목이 허가·신고됐다. 안전성·유효성 심사 대상 등 신규 품목 지속 개발, 국내 제조품목의 허가·신고 우세 경향 유지 등의 추세를 보였다.
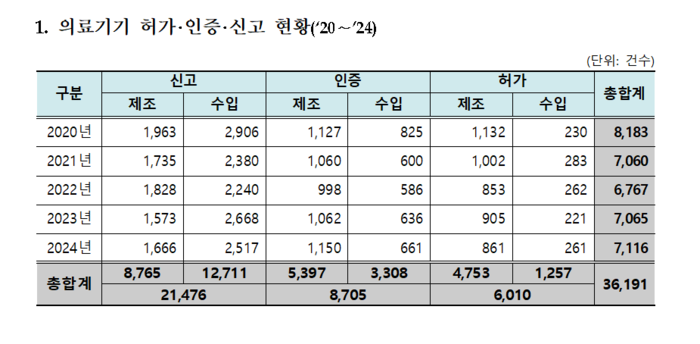
지난해 의료기기는 총 7116개 품목이 허가·인증·신고됐다. 독립형 디지털 의료기기 소프트웨어(SaMD) 품목허가 증가, 조직 수복·피부 관련 의료기기 품목 증대, 인구 고령화에 따른 실버용 의료기기가 매년 다빈도 인허가 상위 품목 포함 등 경향이 나타났다.
식약처 관계자는 “앞으로도 의료제품 허가 등과 관련된 유용한 정보를 적극 제공하겠다”면서 “앞으로도 안전하고 품질이 우수한 의료제품이 많이 개발되도록 최선을 다하겠다”고 말했다.
송윤섭 기자 sys@etnews.com