
유전자치료제 시장이 5년 새 20배나 성장하며 `미래 신약`으로 주목받고 있다. 우리나라에서도 첫 유전자 치료제 판매 허가가 가시화됐다. 새로운 치료제 탄생에 기대가 높지만 높은 가격과 안정성 우려, 기업 연구개발(R&D) 투자 부담 등은 시장 안착에 걸림돌이다.
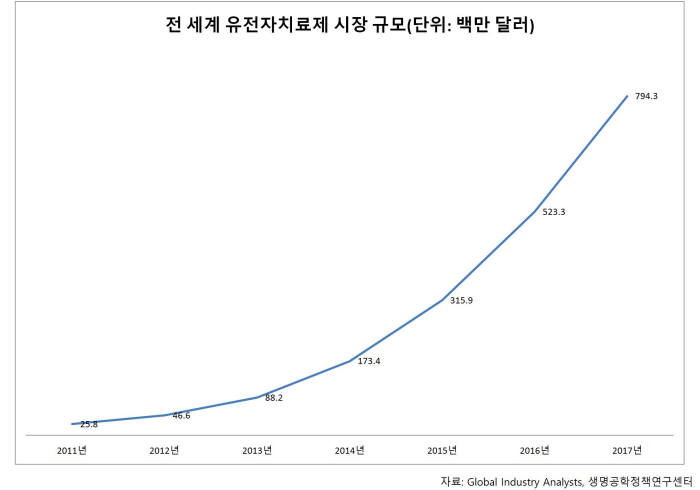
19일 생명공학정책연구센터에 따르면 지난해 세계 유전자치료제 시장은 3억1590만달러(약 3594억원)로 집계된다. 2010년 1670만달러(190억원)에 불과했지만 5년 새 20배나 성장했다. 2017년에는 갑절 이상 커져 7억9430만달러(9040억원)까지 성장할 것으로 예측된다. 연평균 64.7% 고공 성장하고 있다.
유전자 치료제는 결핍이나 결함된 유전자를 교정하거나 교체해 질병을 고친다. 정상기능 유전자를 게놈 안에 삽입, 비정상 유전자를 대체하거나 상동재조합으로 결함 유전자를 정상으로 교체한다. 선택형 역 돌연변이로 결함 유전자를 교정하거나 특정 유전자를 조절하는 방법도 쓰인다.
화학약품에 내재된 부작용을 최소화하면서 희소 유전병을 치료하는 미래 치료제로 주목받는다. 최근 기술이 발전하면서 면역 반응이 손상되지 않는 나노 크기의 유전자 전달체 제작도 가능하다. 그만큼 결함 유전자 대체도 수월해진다.
유전자 치료제 연구는 1990년대 후반부터 본격화됐다. 현재 시장에 출시된 치료제는 4~5개다. 중국 시바이오노와 선웨이 바이오테크는 종양 관련 유전자 치료제를 자국 시장에 상용화했다. 특히 시바이오노가 개발한 두경부암 유전자 치료제 `젠디신`은 2003년 중국 식품의약국(FDA)의 승인을 받으며 세계 최초 유전자 치료제로 주목받았다.
네덜란드 유니큐어의 혈액장애 유전자 치료제 `글리베라`, 러시아 HSCI의 심혈관 유전자 치료제 `네오바스쿨젠`도 유럽과 러시아 시장에 출시됐다.
국내 기업도 상업화에 한 걸음 다가섰다. 코오롱생명과학은 지난 8일 식품의약품안전처에 퇴행성관절염 치료제 `인보사`의 품목 허가를 신청했다. 유전자 치료제로는 국내 최초다. 정상 연골세포와 형질 전환 연골세포를 혼합해 수술 없이 환자에 주사로 투여한다. 품목 허가는 내년에 이뤄질 것으로 예상된다.
바이로메드는 당뇨병성 신경병증 유전자 치료제의 글로벌 임상 3상을 진행하고 있다. 미국과 한국에서 임상 2상을 성공리에 마치고 3상만 남겨 뒀다. 이르면 2019년에 완료될 전망이다.
바이로메드 관계자는 “당뇨병성 신경병증 유전자 치료제로는 처음으로 임상 3상을 진행하고 있다”면서 “이르면 2019년에 시험을 마무리하고 글로벌 판매를 시작할 예정”이라고 설명했다.
유전자 치료제는 대형 제약사 투자 △유전자 가위 등 유전체 편집 기술 발전 △전달체 및 전달 시스템 기술 진보 △미국 시장 개방 등으로 기회를 맞는다. 하지만 안정성 확보, 효소 대체 치료나 줄기세포 등 경쟁 기술 등장, 높은 치료비용 등 넘어야 할 산도 많다. 혈액장애 유전자 치료제 `글리베라`만 해도 연간 15억원이 넘는 비용을 지불해야 하기 때문에 현재까지 구매한 사람은 한두 명에 불과한 것으로 알려졌다.
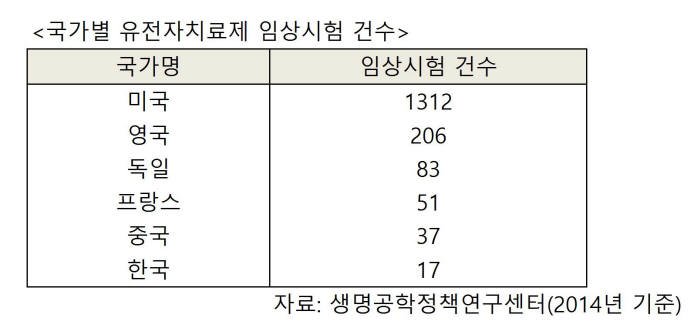
우리나라도 태동기인 유전자치료제 시장에 역량을 집중할 필요가 있다. 2014년 기준으로 국가별 유전자 치료제 임상시험 건수는 미국이 1312건으로 가장 많다. 영국(206건), 독일(83건), 프랑스(51건), 중국(37건) 등이 그 뒤를 잇는다. 우리나라는 총 17건으로 12위에 올랐다.
김무웅 생명공학정책연구센터 팀장은 “유전자치료제 시장은 태동기여서 혁신 신규 기술로 경쟁력을 확보해야 한다”면서 “유전자 가위처럼 우리나라가 주도하는 미래 원천 기술을 확보하자”고 말했다.
정용철 의료/SW 전문기자 jungyc@etnews.com










































