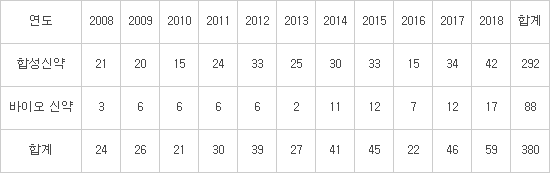
지난해 미국 식품의약국(FDA) 신약 허가가 59건으로 사상 최대치를 기록했다. 신속한 심사로 의약품 시장 진입과 약가 인하 유도를 촉진한 결과다. 생명공학정책연구센터와 관련 업계에 따르면 미국 FDA가 지난해 승인한 신약은 총 59개로 사상 최대를 기록했다. 이전 최대치인 1996년의 53건을 넘어선 데 이어 2016년과 비교, 갑절 이상 늘었다.
FDA는 2016년까지 연평균 31.2개 신약을 승인했다. 도널드 트럼프 정부 출범 이후 규제 완화 정책 실시로 2016년 22개에서 2017년 46건, 2018년 59건 등 신약 허가 건수가 매년 큰 폭으로 증가했다.
역대 최대치를 기록한 신약 허가는 희소질환 치료제 및 혁신 치료제 지정, 우선·신속심사 등 신약 개발 지원제도 강화 덕이다. 희소질환이거나 치료제가 없는 난치병, 공공보건 강화 등 영역에 패스트트랙 정책을 강화했다. 실제로 지난해 59건 신약 허가 사례 가운데 34건이 구루병, 희소유전병인 파브리 질환 등 희소질환 치료제다. 천연두, 인플루엔자, 자궁내막증 등 공공 보건과 여성 질환 치료 영역도 대거 신약 허가를 받았다.
FDA는 트럼프 정부 정책 기조에 맞춰 심사 효율화를 추구하고 있다. 59건 가운데 24건은 신속 심사, 14건은 혁신 치료제, 43건은 우선 심사 대상, 4건은 가속 승인을 각각 받았다. 전체 73%가 하나 이상의 패스트트랙을 거쳤다. 올해도 FDA 기조는 이어질 것으로 보인다. 임상 3상을 넘어 상업화를 눈앞에 둔 국내 바이오·제약사에는 기회다. 최근 대웅제약 보톨리눔톡신제제 '나보타'는 FDA 허가를 획득했고, SK바이오팜 역시 하반기 허가가 유력하다. 한미약품이 기술 수출한 바이오 신약 '롤론티스'와 GC녹십자 '아이비글로불린 에스엔'도 허가 절차에 들어갔다. 바이로메드, 신라젠 등 유전자 치료제 기업도 이르면 올해 글로벌 임상 3상 착수가 예상된다.

FDA 신약 허가 신기록과 우리나라 의약품 해외 진출에 맞춰 국내 의약품 규제 체계 개선 목소리도 높다. 부족한 심사 인력이 신약 허가의 걸림돌로 지적됐다. 이승규 한국바이오협회 부회장은 “올해 국내 바이오·제약 업계 화두는 임상 3상 단계를 상업화까지 이어지게 하는 것”이라면서 “국내 허가는 부족한 심사 인력으로 업체가 부담하는 기간과 비용이 늘어날 수밖에 없는 구조여서 케미컬 의약품 중심으로 식품의약품안전처 내 심사 전문가 충원이 시급하다”고 강조했다.
지난해 우리나라 식약처의 의약품 허가 심사 수수료는 1279만2650원이었다. 미국 FDA(약 28억원)와 비교해 0.2% 수준이다. 업계는 심사 수수료를 높이더라도 인력을 충원해 심사 기간 단축이 필요하다고 주장했다. 최근 10년 동안 국가별 신약 허가 심사 기간을 분석하면 미국 FDA는 평균 243일로, 우리나라와 비교해 200~300일 짧다.
식약처 관계자는 “지난해 말부터 업계와 전문가 의견을 수렴해 심사 수수료 인상 방안을 논의하고 있다”면서 “업체 규모가 다양하기 때문에 합리적인 인상 규모를 검토하고 있다. 이르면 올해 안에 적절한 안을 제시하겠다”고 말했다.
<미국 FDA 연도별 신약 허가 건수(단위:개, 자료:생명공학정책연구센터)
[전자신문 CIOBIZ] 정용철 의료/바이오 전문기자 jungyc@etnews.com