암젠 ‘암제비타’ 지난 1월 포문
셀트리온 등 7종 뒤이어 출시
보험사 대신 협상 중간자 역할
PBM 보험등재 리스트 포함 중요
글로벌 최대 자가면역질환 치료제 휴미라(Humira, 성분명 아달리무맙) 바이오시밀러 대전의 막이 열렸다. 휴미라는 미국 특허가 올해 1월 만료되면서 시장 격전을 예고해왔다.
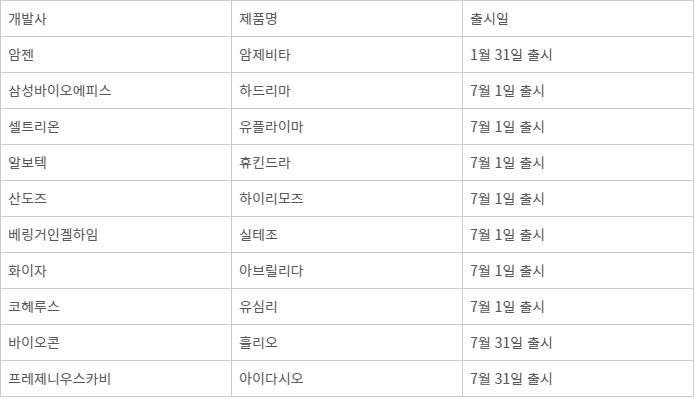
가장 먼저 포문을 연 것은 암젠의 암제비타다. 암젠은 지난 1월 31일 휴미라 바이오시밀러인 암제비타를 출시했다. 암제비타는 지난 2016년 9월 미국 식품의약국(FDA) 허가를 취득했다.
암제비타 뒤를 이어 이달 1일 출시된 휴미라 바이오시밀러는 셀트리온의 '유플라이마', 삼성바이오에피스의 '하드리마', 산도스의 '하이리모즈', 알보텍의 '휴킨드라', 베링거인겔하임의 '실테조', 화이자의 '아브릴라다', 코헤루스의 '유심리' 등 7종이다. 바이오콘의 '훌리오', 프레제니우스카비의 '아이다시오'는 이달 31일 출시가 예고돼 있다. 암제비타를 맹추격하겠다는 전략이다.
후발 제약사들은 오리지널 개발사인 애브비와 라이선스 합의로 '휴미라' 시밀러 미국 판매를 허용받았다. 휴미라는 류마티스 관절염 등 자가면역질환 치료제다. 2012~2020년 9년 연속 전세계 매출 1위를 기록한 블록버스터 의약품이다.
2016년 주요 특허(물질특허) 만료 이후에도 추가 특허(미국 기준 총 312건 출원 및 166건 등록, 최대 2038년 만료)로 북미 시장에서 독점기간을 연장해왔다. 지난해 미국에서만 18.6억달러(한화 2조5000억원) 매출을 달성했다. 시장이 워낙 큰 만큼 기업들의 바이오시밀러 경쟁이 치열하다.
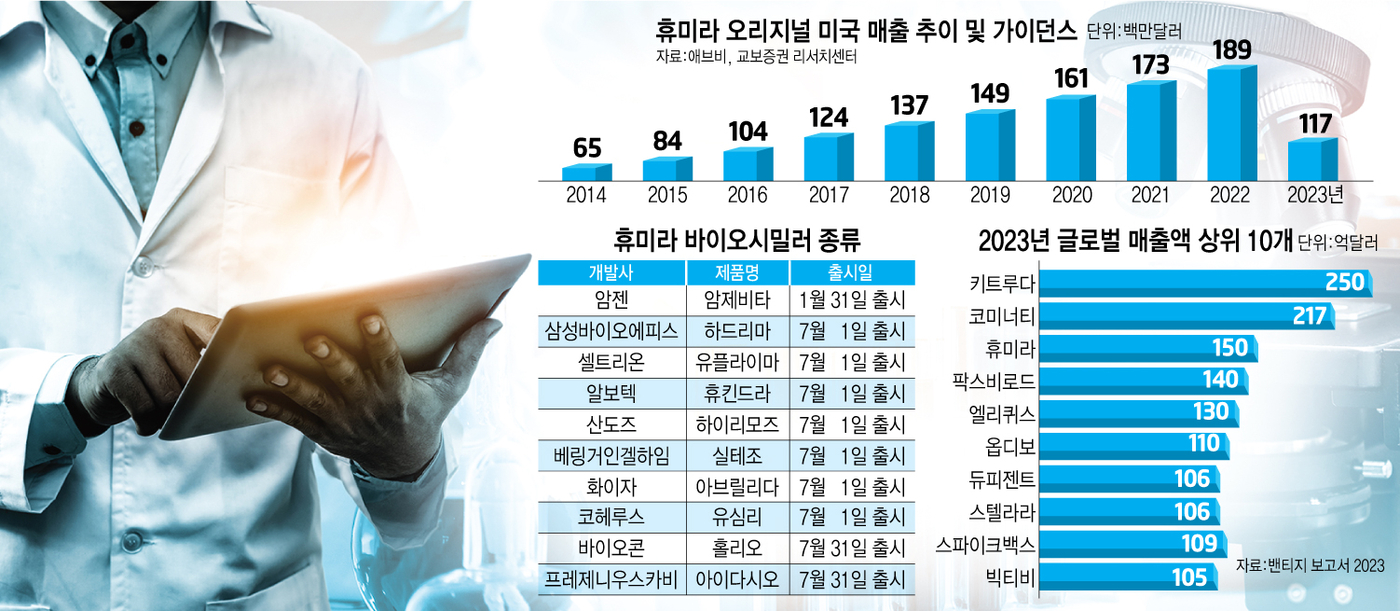
휴미라 바이오시밀러 시장에서 승기를 잡는 관건은 △접근성 △가격 △제품경쟁력 △생산역량이다. 이 중 접근성을 높이려면 미국 의료 시장에서 주요 구매자인 사보험인 처방약급여관리업체(PBM)이나 메디케어 등 보험 시장에 최대한 폭넓게 등재돼야 한다.
휴미라 바이오시밀러가 미국 사보험 시장을 진출하려면 PBM 보험등재 리스트에 포함되는 것이 중요하다. PBM은 보험사를 대신해 제약사와 약가 및 리베이트를 협상하는 의약품 결제 중간자 역할을 한다. PBM이 보험사를 대신해 처방약 목록을 관리하는 막강한 권한을 갖고 있다. 미국은 공식적으로 리베이트가 인정되기 때문에 이들 PBM에 바이오시밀러가 공급될 수 있도록 선점하고 공급가와 리베이트가를 어떻게 책정하는지도 중요하다.
현재 미국 휴미라 PBM 시장은 CVS케어마크(33%)와 익스프레스 스크립트(24%), 유나이티드 헬스 그룹 산하의 옵텀RX(21%) 등 3개 대형 PBM이 약 80%에 달하는 시장 점유율을 형성하고 있다. 3개사의 보험등재 리스트에 포함이 되면 시장 점유율을 크게 올릴 수 있게 된다. PBM에 등재되지 않으면 사실상 약국 판매가 불가능해 제품 성패가 갈린다.
최근 셀트리온과 삼성바이오로직스의 미국 보험 등재 이슈가 있었다. PBM 시장 20% 이상을 차지하는 옵텀RX가 휴미라 바이오시밀러 추가 등재로 암젠의 암제비타, 산도즈의 하이리모즈, 베링거인겔하임의 실테조를 확정지었다. 앞서 지난해 말 옵텀RX는 휴미라 바이오시밀러 3개만 등재한다고 밝혔다. 다른 PBM인 CVS케어마크는 당분간 오리지널 휴미라 등재만 유지한다고 밝혔다. 이 때문에 익스프레스 스크립트에 등재 되지 않으면 시장 경쟁력을 가질 수 있을지 불확실한 상황이다.
셀트리온헬스케어 측은 보험 등재와 관련해 “휴미라가 속해있는 시장은 상위 3개 PBM이 처방의 80%를 담당하고 있으며, 다시 사보험과 공보험으로 나뉜다”며 “옵텀RX가 확보하고 있는 휴미라 시장 21% 중 약 10%를 커버하는 포뮬러리와의 계약 내용에 해당하며, 다른 PBM들과 협의를 지속하겠다”고 설명했다.
허혜민 키움증권 연구원은 “이번 등재는 옵텀의 사보험 영역으로, 옵텀 내에서도 공보험과 사보험의 비중이 약 45%, 55%로 공보험 등재도 여전히 남아 있다”고 설명했다. 아직 가능성이 남아 있다는 뜻이다.
제품 경쟁력도 중요하다. 제품 경쟁력은 대체처방(인터체인저블, interchangeable) 여부와 고농도·저농도 여부, 구연산염 제거 여부 등에 따라 결정된다. 의사가 기존에 오리지널 의약품을 처방받는 환자들에게 바이오시밀러를 처방할지 여부는 중요하다. 또 바이오시밀러가 인터체인저블에 등록될 경우 임상 의사 처방과는 관계없이 약국에서 이를 대체 처방할 수 있다.
FDA 인터체인저블 바이오시밀러 지정 여부도 시장에 영향을 미칠 수 있다. 현재까지 허가된 8개 휴미라 바이오시밀러 중에서 인터체인저블 바이오시밀러로 허가받은 제품은 독일 베링거잉겔하임 실테조다. 알보텍의 휴킨드라 등 다른 몇몇 기업들도 인터체인저블 지정을 받기 위한 추가 임상 진행 중에 있다.
인터체인저블로 지정받은 바이오시밀러가 일반 바이오시밀러보다 안전성과 유효성에 차이가 있거나 우월한 것은 아니다. 하지만 의사나 약사가 바이오시밀러를 처방할 때 인터체인저블 지정을 받은 바이오시밀러 대체 처방에 부담을 덜 느끼는 것으로 알려졌다. 이 때문에 인터체인저블 지정 여부는 상업적 성공에 상당히 중요한 요인으로 꼽힌다.
휴미라의 개발사인 애브비는 경쟁사들이 바이오시밀러를 속속 내놓으며 시장 침투를 가속화하는 가운데 기존 PBM을 통한 시장 방어 전략과 의·약사의 오리지널 처방 관성 등을 사용한다는 계획이다.
송혜영 기자 hybrid@etnews.com