한미약품 바이오 신약 '롤론티스'의 미국 식품의약국(FDA) 허가 여부가 다음 달 결정된다. 한미약품이 개발한 신약이 미국 진출에 첫 테이프를 끊을지, 3년 만에 국산 신약이 FDA 승인을 받는 사례가 될지 최종 결과에 관심이 쏠리고 있다.
다음 달 9일(현지시간) 이전까지 롤론티스의 미국 시판 허가 여부가 결정된다. 처방의약품 신청자 수수료법(PDUFA)에 따라 FDA가 허가 신청을 접수하면서 통보한 승인 심사 기한이 9월 9일이기 때문이다. 롤론티스가 허가를 받아 시판되면 한미약품은 라이선스 계약에 따른 마일스톤(단계별 기술료)과 로열티 수입을 받게 된다. 시판 허가 절차의 마지막 단계로 꼽히는 생산 공장 실사까지 마친 것으로 전해졌다.
롤론티스는 한미약품이 개발해 2012년 스펙트럼에 기술을 수출한 '호중구감소증' 치료제다. 호중구감소증이란 백혈구 가운데 40~70%를 차지하는 호중구가 비정상적으로 감소, 감염에 취약해지는 질환이다. 암 환자가 항암화학요법 치료를 받을 때 종종 부작용으로 동반된다. 롤론티스는 호중구감소증 치료 또는 예방 용도로 투여된다. 국내에서는 국산 33호 신약으로 지난해 3월 허가를 받았다.
한미약품과 파트너사 스펙트럼은 세 번째 도전 만에 FDA 허가를 기대하고 있다. 스펙트럼은 지난 2018년 FDA에 롤론티스 바이오의약품품목허가(BLA)를 신청했지만 FDA의 추가 자료 보완 요구에 따라 신청을 자진 취하했다. 이듬해 다시 품목허가를 신청했으나 FDA로부터 보완요구서(CRL)를 받았다. 다시 BLA를 제출했지만 코로나19 대유행으로 현장실사가 지연되다가 CRL을 받았고, 올해 3월 세 번째 BLA를 접수했다.
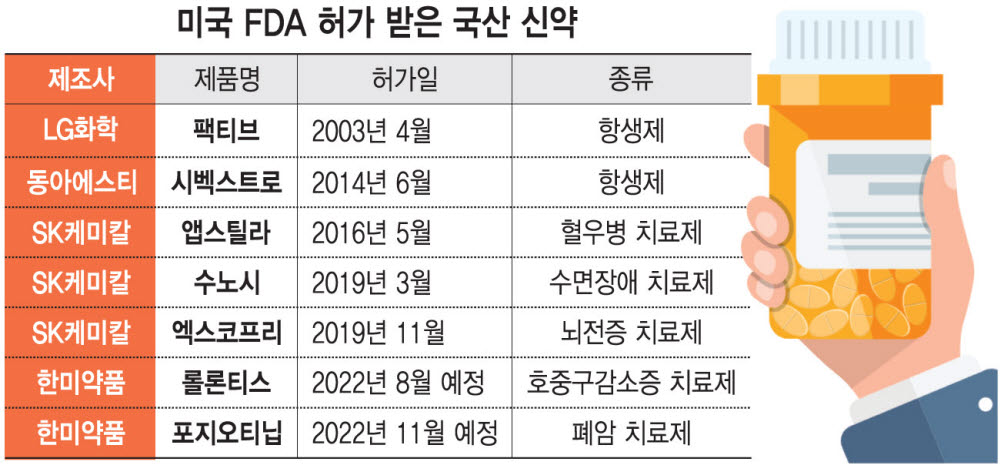
롤론티스가 허가를 받으면 한미약품의 독자 플랫폼 기술인 '랩스커버리'가 적용된 바이오신약 가운데 글로벌 시장에 처음 진출하는 제품이 된다. 랩스커버리는 약물의 체내 지속 기간을 늘리는 기술로 반감기가 짧은 바이오 의약품 단점을 극복했다. 2019년 11월에 승인된 SK바이오팜 '엑스코프리' 이후 6번째 FDA 허가 국산 신약도 된다. 현재까지 국산 신약 가운데 FDA 허가를 받은 제품은 LG화학 '팩티브', 동아에스티 '시벡스트로', SK케미칼 '앱스틸라', SK바이오팜 '수노시'와 '엑스코프리' 등 5종이다. 한미약품이 스펙트럼에 기술 수출한 비소세포폐암 치료제 '포지오티닙'도 FDA 심사를 받고 있어 주목된다. 포지오티닙의 FDA 승인 심사 기한은 오는 11월 24일이다.
제약업계 관계자는 “한미약품이 2010년 신약 연구개발(R&D)에 공격적으로 투자하기 시작한 이후 첫 미국 허가라는 점에서 주목하고 있다”면서 “적극적인 R&D 투자를 통한 신약 개발이라는 새로운 화두를 주도해온 만큼 국내 제약 업계에도 의미 있는 이정표가 될 것”이라고 말했다.
정현정기자 iam@etnews.com











































