
시행 5년째를 맞는 혁신형 제약기업 인증의 개편 목소리가 높다. 연구개발(R&D) 투자를 유도해 글로벌 제약기업 육성을 목표로 했지만 `계륵` 신세로 전락했기 때문이다.
오는 20일이면 보건복지부 제3차 혁신형 제약기업 인증 신규 신청이 마감된다. 마감이 일주일도 채 안 남았지만 실효성 논란 등으로 업계는 관망하고 있다.
혁신형 제약기업 인증은 신약 개발 R&D와 해외 진출 역량이 우수하다고 입증된 기업에 부여한다. 연간 의약품 매출액 1000억원 미만 업체는 연간 50억원 또는 의약품 매출 7%, 1000억원 이상 기업은 연간 의약품 매출 5% 이상을 R&D에 투자해야 신청할 수 있다.
2012년에 처음 시행된 인증제는 2년에 한 번 인증 유지와 신규 신청을 받는다. 현재 한미약품, 대웅제약, 녹십자, 셀트리온 등 40개 기업이 인증을 받았다. 시행 초기에는 혁신 제약기업이라는 상징성과 세제 혜택 때문에 업계의 관심이 높았다.
지금은 사정이 달라졌다. 제3차 신규인증 신청 마감을 앞두고 업계의 반응은 예년만 못하다.
제약업계는 R&D 세액공제를 제외하면 인증기업이 기대할 수 있는 효과가 거의 없다고 주장하고 있다. 투자 유도의 동기 부여가 약하다는 게 이유다.
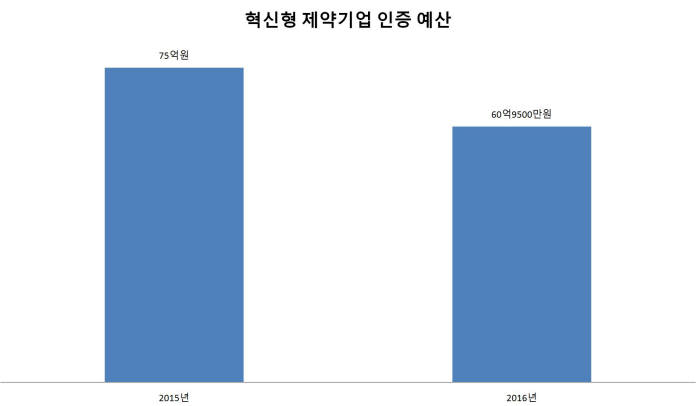
복지부는 지난해 말 인증제 인센티브 강화를 위해 특별법까지 만든다고 밝혔다. 이후 개선책은커녕 오히려 올해 예산(60억9500만원)을 약 20% 줄였다.
불법 리베이트 등으로 인한 인증 취소도 과징금 6억원 이상 또는 3회 이상 처분을 받은 기업에 해당하기 때문에 부실한 형편이다. 제약업계는 실제 혁신 역량을 갖춘 기업에 인증제도 혜택이 돌아가도록 기준을 강화해야 한다고 지적했다.
제약업계 관계자는 “40개 기업이 인증을 받아 일부만 세제 혜택을 받지만 기업이 체감하기 어려워 사실상 마케팅 수단으로만 활용하고 있다”면서 “R&D 세액공제율을 상향 조정하고, 약가 인하 효과를 상쇄하는 실질적 지원이 필요하다”고 주장했다.
정부도 인증제 개선이 필요하다는 입장이다. 2012년 당시 시장 환경, 사회 분위기와 현재의 차이가 크다. 한미약품을 비롯해 국내 제약사의 글로벌 진출이 봇물을 이루고 있다. R&D 투자도 대폭 강화됐다.
최종희 복지부 보건산업진흥과장은 “인증제가 처음 만들어질 때와 현재의 산업 환경은 크게 변해 개편이 필요하다”면서 “올해 안에 연구용역을 발주해 전반에 걸친 개선책을 마련, 이르면 2017년에 적용할 계획”이라고 밝혔다.
정용철 의료/SW 전문기자 jungyc@etnews.com











































