
우리나라가 바이오시밀러 개발 핵심 단계인 `동등성 평가` 지침서 개발을 주도한다. 오리지널 의약품과 효능 유사성을 검증하는 방법론을 제시한다. 앞으로 국제표준으로 적용되면 세계 바이오시밀러 시장의 영향력이 높아질 것으로 기대된다.
식품의약품안전처는 세계 바이오의약품 규제 당국과 협의, 바이오시밀러 동등성 평가를 위한 과학적 지침서를 개발한다고 16일 밝혔다. 개발 과정에서 투명성과 예측 가능성을 확보하는 게 목적이다.
동등성 평가는 바이오시밀러와 오리지널 의약품 간 효능 유사성을 입증하는 과정이다. 안전성과 함께 바이오시밀러 개발의 최종 관문이다. 세계 각국은 바이오시밀러 허가·심사 관련 가이드라인을 제정했다. 동등성 평가·판정 기준 가이드라인은 미비한 상태다. 통상 품질, 비임상, 임상 등 시험단계별 기준이나 통계적 설계, 평가변수, 신뢰구간 등 평가요소별 판정 기준을 활용한다.
과학적 지침서는 국가별 동등성 평가·판정 기준을 분석하고 표준화된 방법론을 제시하는 일종의 참고서다. 다양한 평가 모델을 살펴서 객관성 입증이 뛰어난 모델을 제시한다. 동등성 평가 과정을 지원하는 내용도 담긴다.
식약처 관계자는 “우리나라를 비롯해 세계 각국에서도 바이오시밀러에 관한 포괄 가이드라인은 있지만 동등성 입증 관련 가이드라인이나 지침은 없다”면서 “바이오시밀러 특성에 따라 각기 다른 동등성 평가 방법을 분석해 정보를 제공하는 지침서를 만들 예정”이라고 밝혔다.
지침서 개발은 우리나라가 주도한다. 식약처는 2014년부터 국제의약품규제자포럼(IPRF) 바이오시밀러 실무그룹 의장국으로 활동하고 있다. IPRF는 의약품 규제 이슈 공유와 규제기관 상호협력을 위해 2008년에 설립됐다. 우리나라를 비롯해 미국, 유럽연합(EU), 일본, 캐나다 등 규제 당국 대표가 참여한다.
우리나라가 주도한 과학적 지침서는 세계 시장에서 한국 기업의 입지를 제고할 것으로 기대된다. 국내에서는 2012년 셀트리온 `램시마`를 비롯해 총 5개 바이오시밀러가 식약처의 허가를 받았다. 현재 임상 중인 약품도 12개에 이른다. 동등성 평가 방법론은 이들 기업에 적지 않은 도움이 된다.
바이오시밀러 개발 업체 관계자는 “세계 바이오시밀러 시장이 자리 잡은 지 얼마 되지 않아 동등성 평가를 비롯한 정보가 부족하다”면서 “가이드라인이나 지침이 많이 제공된다면 개발 과정에 시행착오를 줄일 수 있다”고 설명했다.
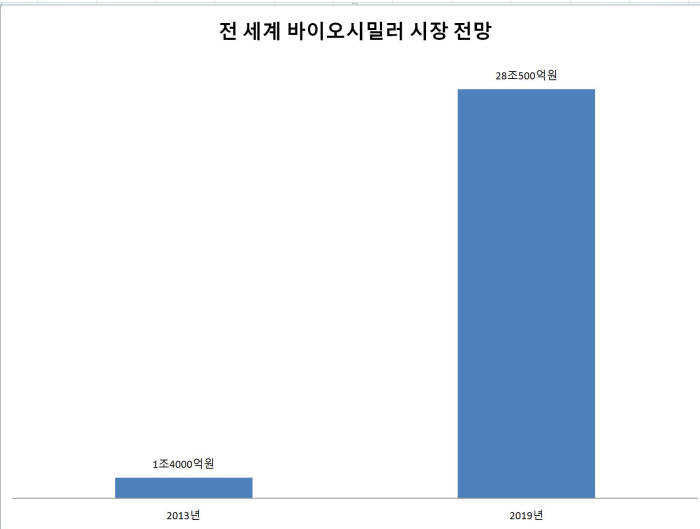
식약처는 과학적 지침서를 고도화해 세계가 공유하는 가이드라인으로 발전시킬 계획이다.
식약처 관계자는 “세계 각국의 규제 당국, 바이오시밀러 기업과의 협의가 우선이지만 지침서를 고도화해 국제표준 가이드라인으로 발전시킬 구상”이라고 말했다.
정용철 의료/SW 전문기자 jungyc@etnews.com










































