국내 연구진이 종양세포가 악성으로 변화하는 새로운 메커니즘을 제시하고, 이를 억제하기 위한 키나아제 억제 저분자 항암제를 발굴하는 데 성공했다.
광주과학기술원(GIST·총장 김기선)은 남정석 생명과학부 교수팀이 악성종양 세포에 특이적으로 발현하는 단백질 DCLK1이 염증성 효소인자를 통해 종양미세환경내 친종양형성 신호 경로를 활성화해 종양세포 악성화를 촉진한다는 사실을 규명했다고 25일 밝혔다.
키나아제는 종양세포 성장·분화·생존을 조절하는 신호 전달 경로에서 스위치 역할을 하는 세포내 단백질이다. 종양세포 악성화는 비정상적인 분화 및 과잉 성장하는 세포 덩어리인 종양이 빠른 성장과 침윤성, 전이성을 획득하는 악성화 과정을 통해 악성종양, 즉 암으로 진행한다. 종양세포 악성화 과정은 발생·증식·전이·재발을 포함하는 개념으로 종양세포와 종양미세환경 사이의 상호작용에 의해 매개되는 것으로 알려져 있다. 따라서 종양세포의 악성화 과정에 대한 구체적인 메커니즘을 규명하고, 이를 제어할 수 있는 치료 전략을 수립하는 것은 난치성 질병의 치료 개발에 필수적이다.
남 교수팀은 한국화학연구원 연구팀과 협력해 가상현실(VR) 기반 분자 모델링 연구를 통해 DCLK1 활성을 억제하는 저분자 유효화합물을 발굴했다. 생쥐 실험을 통해 DCLK1 키나아제 활성 억제 저분자 유효화합물이 종양세포 악성화를 효과적으로 제어하는 것을 확인했다. 이를 바탕으로 종양세포-종양미세환경 상호작용에 의한 악성화 치료기술 확립에 실험적 근거를 제시했다.
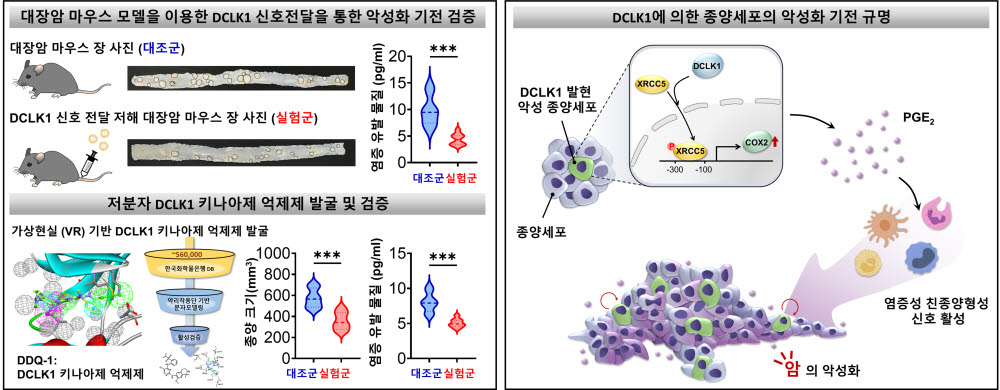
연구팀은 또 임상데이터 분석을 통해 DCLK1이 염증 반응으로 암을 유발할 뿐만 아니라 악성화도 일으킨다는 것도 새롭게 규명했다. 특히 단백질체 분석을 통해 악성종양과 염증을 매개하는 신호전달 단백질(XRCC5)을 처음으로 규명하고 이를 기반으로 대장암 마우스 모델에서 XRCC5에 대한 유전자 치료를 통해 두 단백질에 대한 매개 신호 억제가 종양세포의 악성화를 억제하는 것을 입증했다.
DCLK1이 XRCC5와 결합해 염증성 효소인자 COX2의 발현을 증가시켜 염증 물질(PGE2) 합성을 촉진하고 종양미세환경내의 친종양형성 신호 경로를 활성시켜 종양세포의 악성화를 가속시키는 것도 증명했다.
연구팀은 56만개 약물 라이브러리를 활용한 3D 가상 스크리닝을 통해 악성종양 세포에서 특이적으로 발현하는 키나아제를 억제하는 저분자 항암제를 도출했으며 이를 이용한 항암치료 전략에 대한 특허를 출원했다.
남정석 교수는 “이번 성과는 종양세포의 악성화 과정을 제어해 난치성 질병을 근본적으로 치료할 수 있는 약물을 개발하는 데 기여할 것으로 기대하고 있다”고 말했다.

남 교수가 주도하고 김지흔 GIST 박사과정생과 박소연 GIST 박사가 참여한 이번 연구는 한국연구재단의 중견연구자지원사업, 신진연구자지원사업, 박사과정생연구장려금 지원사업, SRC 선도연구센터 지원사업, 지스트 GRI 사업 지원으로 이뤄졌다. 의학 분야 상위 4.62% 전문 권위지인 '테라노스틱스'에 최근 온라인 게재됐다.
광주=김한식기자 hskim@etnews.com






































