

정부 규제 완화, 기술 발전 등으로 줄기세포를 이용한 난치성 질환 정복이 새 국면을 맞고 있다. 줄기세포치료제 임상연구 수준도 한층 성장, 바이오산업 효자 영역으로 자리매김할 전망이다.
31일 보건복지부와 바이오 업계에 따르면 우리나라 줄기세포치료 연구가 규제 개선, 투자 확대, 기술 발전 등으로 가속페달을 밟고 있다.
줄기세포는 모든 조직세포로 분화할 수 있는 세포다. 이를 이용해 심장 근육세포, 뇌 질병을 치료할 신경세포 등을 만드는 연구가 진행되고 있다. 인간 세포를 키워 난치병을 치료하기 때문에 부작용도 적다.
줄기세포 연구를 위한 난자 채취 과정에서는 과배란 유도, 동의 없는 난자 제공 등 윤리 및 법 관련 문제가 발생할 소지가 있다. 현행 생명윤리법상 체외 수정이 되지 않은 미성숙 난자, 비정상 난자의 활용은 제한된다.
정부는 최근 연구 제한 족쇄를 연이어 풀었다. 바이오헬스케어 규제 혁신을 위해 줄기세포치료제 개발 시 배아 사용 요건을 개선했다. 줄기세포치료제 개발에 사용하는 배아 기증자 병력 정보 확인을 보존된 세포를 이용한 안전성 검사로 대체했다. 그동안에는 기증자 병력 정보가 확인되지 않으면 활용할 수 없었다. 줄기세포, 유전자 치료제 개발 등 영역에 800억원 펀드를 조성하는 지원책도 발표했다.
체세포 복제 방식의 배아 줄기세포 연구도 재추진된다. 지난달 17일 대통령 직속 국가생명윤리심의위원회는 이동률 차병원 줄기세포연구소 교수팀이 복지부에 제출한 체세포 복제 배아 연구계획을 조건부로 승인했다. 난자·체세포 채취 과정을 투명하게 하고, 인간 복제에 악용될 가능성을 감지하는 체계를 갖추는 게 허가의 전제 조건이다.
정부 규제 완화는 줄기세포 기술력에 날개를 달아 준다. 질병 치료뿐만 아니라 산업 육성에도 기여한다.

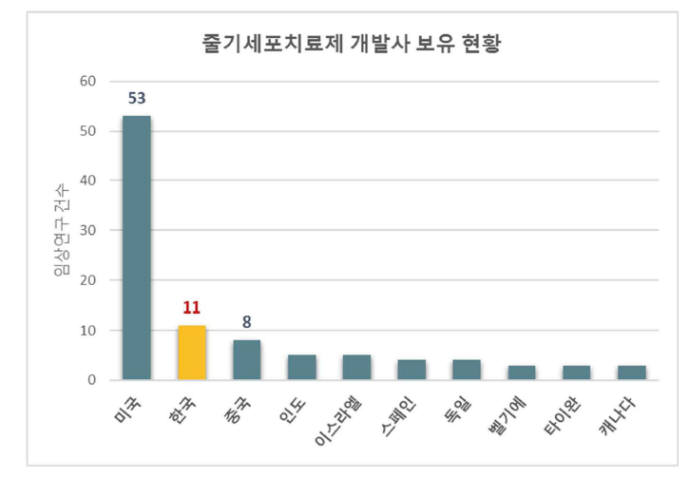
식품의약품안전평가원의 `줄기세포치료제 개발 및 규제 동향 2015`에 따르면 1998~2015년 상업 개발을 목적으로 한 줄기세포치료제 임상연구 317건 가운데 우리나라에서 진행된 사례는 46건에 이른다. 미국(146건)에 이어 세계 2위다. 우리나라는 매년 40건 이상 줄기세포치료제의 상업 임상 연구가 진행된다. 줄기세포치료제 개발 기업도 우리나라는 총 11개로 미국(53개)에 이어 2위를 기록했다.
메디포스트는 퇴행성 관절염 환자 무릎연골 결손(카티스템), 미숙아 기관지폐이형성증(뉴모스템), 알츠하이머(뉴로스템) 등 영역에서 개발·임상을 진행하고 있다. 카티스템, 뉴모스템은 미국식품의약국(FDA) 임상 1·2상을 진행한다. 차바이오텍은 노인성 황반변성, 간헐성 파행증, 급성 뇌졸중, 알츠하이머, 퇴행성 디스크 관련 줄기세포 치료제를 개발하고 있다. 파미셀 역시 2011년 급성심근경색 줄기세포 치료제에 이어 간경병, 뇌질환, 척수질환 치료제를 개발하고 있다.
이달 초에는 줄기세포, 조직공학, 유전자 치료 등 산업계가 모여 첨단재생의료 산업협의체를 발족했다. 국내 기업 간 정보 공유는 물론 글로벌 네트워크 구축으로 국내 재생의료 산업의 입지를 강화한다.
메디포스트 관계자는 “정부 발표는 알츠하이머 등 각종 난치병 환자와 가족에게 희망을 주고 기업에 난치병 치료 개발에 도전하는 동력을 제공한다”면서 “줄기세포 치료제 개발 기업의 사기를 높여 줄 것”이라고 기대했다.
정용철 의료/SW 전문기자 jungyc@etnews.com










































