HK이노엔은 세계 최대 의약품 시장인 미국에서 위식도역류질환 신약 케이캡(K-CAB) 신약 허가 절차에 본격 돌입했다고 13일 밝혔다.
HK이노엔은 미국 파트너사 세벨라 파마슈티컬스의 계열사이자 소화기 의약품 전문 기업인 브레인트리가 지난 9일(현지시간) 위식도역류질환 치료제 케이캡(성분명 테고프라잔, 이하 '테고프라잔')의 신약 허가 신청서(NDA)를 미국 식품의약국(FDA)에 제출했다. 2027년 1월 미국 허가가 기대된다.
이번 NDA는 △비미란성 위식도역류질환(NERD) 치료 △미란성 식도염(EE) 치료 △미란성 식도염 치료 후 유지요법 등 세 가지 적응증에 대한 동시 승인을 목표로 한다.
이번 NDA 제출은 2000명 이상의 미국 환자가 참여한 핵심 3상 임상시험 'TRIUMpH 프로그램'에서 확보한 우월한 임상 데이터를 기반으로 이뤄졌다. TRIUMpH 임상시험에서 P-CAB계열 테고프라잔은 다수의 평가지표에서 기존 치료제인 PPI 약물 대비 임상적 우월성을 입증했다. 모든 평가지표는 사전에 규정된 계층적 다중 검정 절차에 따라 분석됐다.
비미란성 위식도역류질환 환자에서 테고프라잔은 24시간 가슴 쓰림이 없는 날의 비율에서 위약 대비 우월성을 보였다. 야간 가슴 쓰림이 없는 날의 비율과 위산 역류 증상이 없는 날의 비율에서도 위약 대비 우월성을 나타냈다.
모든 등급(LA 등급 A-D)의 미란성 식도염 환자에서 테고프라잔은 2주 및 8주 시점 모두 PPI계열인 란소프라졸 대비 통계적으로 유의미한 우월성을 보였다. 중증 환자(LA 등급 C, D)에서도 2주 및 8주 시점 모두에서 우월성을 입증해 중증 환자 치료에서의 차별적 가치를 확인했다.
24주 간의 미란성 식도염 치유 후 유지요법에서도 테고프라잔은 모든 환자군에서 PPI 계열 약물 대비 지속적인 치유 유지 효과에서 우월성을 보였다. 중증 환자군에서도 치유 유지 및 가슴 쓰림 완화 효과가 뛰어난 것으로 나타났다.
세벨라는 올해 예정된 주요 학회에서 TRIUMpH 프로그램의 전체 결과를 발표하고, 권위 있는 학술지에도 해당 내용을 게재할 계획이다.
곽달원 HK이노엔 대표는 “당사가 개발한 대한민국 신약 케이캡이 미국에서 우수한 임상시험 결과로 신약 허가 절차를 밟게 돼 기쁘다”며 “세계 시장을 선도하는 글로벌 베스트 인 클래스(Best in class)제품으로써 유럽 수출 및 일본 개발도 적극 추진할 것”이라고 말했다.
앨런 쿡 세벨라 파마슈티컬스 대표는 “미국 내 약 6500만 명의 위식도역류질환 환자 중 35%~54%는 기존 치료제로도 증상이 충분히 조절되지 않아 고통받고 있다”며 “FDA와 협력해 미국 허가 승인을 획득해 내년 1월 환자와 의료진에게 테고프라잔이 치료 옵션을 제공할 수 있기를 기대한다”고 말했다.
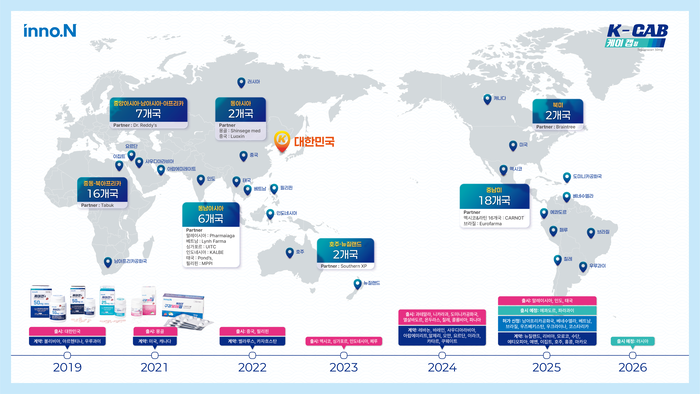
테고프라잔은 HK이노엔이 개발한 대한민국 제30호 신약 '케이캡'의 성분명이다. P-CAB계열 위식도 역류질환 신약 케이캡은 △약효 발현 △약효 지속 시간 △미란성 식도염 치유 및 유지에서 PPI계열 약물 대비 우수한 유효성을 입증했다. 국내에서 2019년 3월 출시돼 지난해까지 누적 9233억원의 원외처방실적을 기록하며 국내 소화성 궤양용제 원외처방실적 1위를 유지하고 있다.
해외 55개국과 기술수출 또는 완제수출 계약을 체결했고, 이 중 대한민국 포함 22개국에서 허가, 19개국에 출시됐다.
송혜영 기자 hybrid@etnews.com