우리 연구진이 DNA 손상으로 복제 장애가 발생해도 DNA 합성 정상 재개를 돕는 암 억제 단백질 'ATAD5'의 새로운 역할을 밝혀냈다.
기초과학연구원(IBS·원장 노도영)은 유전체 항상성 연구단(단장 명경재)의 강석현 연구위원팀이 ATAD5가 DNA 손상 시에도 복제가 중단되지 않도록 유도하는 '손상우회 신호'를 부적절하게 증폭되지 않도록 조절, 유전체 안정성을 유지하는 역할을 한다는 것을 밝혀냈다고 전했다.
DNA 손상으로 복제 장애가 발생하면, 합성 중인 DNA를 감싼 다양한 단백질과 DNA 간 상호작용을 매개하는 필수 단백질 '증식세포항원(PCNA)'이 유비퀴틴 단백질과 결합한다. 유비퀴틴화가 일어난다.
유비퀴틴화된 PCNA(Ub-PCNA)는 DNA 손상복구 단백질들을 손상 부위로 끌어와 복제가 계속될 수 있도록 유도하지만, 이는 부정확하고 비효율적이다.
그래서 탈유비퀴틴화 효소를 통해 Ub-PCNA에서 유비퀴틴이 제거돼야 정상적인 DNA 합성을 재개할 수 있지만, 이러한 Ub-PCNA 탈유비퀴틴 과정은 지금껏 규명되지 않아왔다.
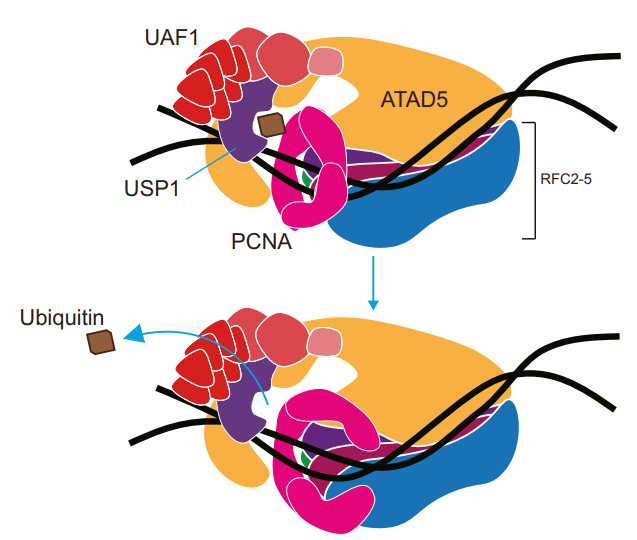
이에 IBS 연구팀은, ATAD5가 탈유비퀴틴화의 핵심 인자임을 규명했다. 다양한 돌연변이를 이용해 ATAD5의 N-말단 부위가 DNA에 결합된 Ub-PCNA를 인식하고, 탈유비퀴틴화 효소인 UAF1-USP1 복합체를 불러들여 Ub-PCNA를 변형 전의 PCNA로 환원시키는 탈유비퀴틴화 과정을 설명했다.
특히 돌연변이 ATAD5 단백질을 발현하는 세포를 이용해, ATAD5가 PCNA 탈장착 과정과 탈유비퀴틴화 과정을 동조화시켜 핵 내에 Ub-PCNA가 쌓이지 않도록 조절함으로써 DNA 손상우회의 부적절한 증폭과 활성화를 막음을 확인했다.
또 ATAD5 단백질과 탈유비퀴틴화 효소 USP7-USP11 간의 새로운 상호작용을 발견해 이들이 UAF1-USP1 복합체와 함께 다중 유비퀴틴화 PCNA의 효율적 탈유비퀴틴화에 기여함을 확인했다.
더 나아가, 생쥐 모델을 통해 탈유비퀴틴화 효소와의 결합을 방해하는 ATAD5의 돌연변이가 Ub-PCNA의 탈유비퀴틴화를 억제하고, 생쥐 피부의 UV에 의한 DNA 손상을 증가시킴을 확인해 DNA 복제 및 손상복구 과정이 어떻게 연동돼 유전체 안정성을 유지하는지 이해하는 중요한 단서를 찾았다.
강석현 IBS 연구위원은 “향후, ATAD5와 탈유비퀴틴화 효소 복합체의 구조적 특성을 밝히고 그 생화학적 활성과 연계해 Ub-PCNA의 탈유비퀴틴 과정을 효과적으로 제어할 수 있는 방법을 찾을 예정”이라고 앞으로의 연구계획을 밝혔다.
이 연구 결과는 세계적인 미국국립과학원회보 (PNAS, IF 9.4)에 2024년 8월 13일(한국시간 오전 4시) 온라인 게재됐다.
김영준 기자 kyj85@etnews.com