국내 혁신의료기기로 지정된 디지털치료제가 20개를 돌파했다. 이중 절반 가까이가 올해 상반기에 지정된 것으로, 국내 시장이 연구개발(R&D)을 넘어 상업화 단계에 본격 진입했다는 평가다. 디지털치료제가 치료 대안으로 주목받고 있지만 글로벌 경쟁력 확보를 위해선 수가체계를 개편해야 한다는 목소리가 높다.
22일 식품의약품안전처에 따르면 현재 혁신의료기기(일반·통합)로 지정받은 디지털치료제는 총 21개로, 이 중 9개가 올해 신규 지정됐다.
디지털치료제는 특정 질환의 치료·예방을 목적으로 한 소프트웨어(SW) 기반 의료기기다. 주로 경도인지장애, 우울증, 주의력결핍과잉행동장애(ADHD) 등 환자를 대상으로 다양한 콘텐츠를 이용해 질환을 치료한다.
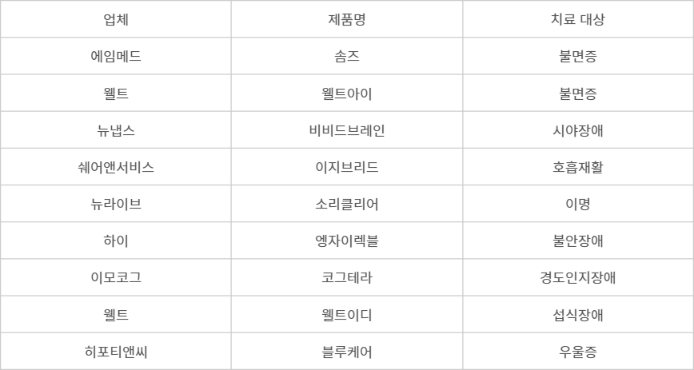
2022년 12월 에임메드와 웰트의 불면증 디지털치료제가 1호 혁신의료기기로 지정된 이후 시장에 제품이 꾸준히 출시되고 있다. 연도별로 보면 2022년 3건을 시작으로 2023년 5건, 2024년 5건을 기록했다.
올해는 그 수가 큰 폭으로 늘어나고 있다. 올해만 유비플러스(D-STOP), 뉴라이브(소리클리어), 에스알파테라퓨틱스(SAT-014) 등 총 9개 제품이 혁신의료기기로 지정됐다. 이미 지난해 전체 지정 건수를 넘어섰으며, 하반기 지정 예정인 것까지 포함하면 그 수가 더 늘 것으로 예상된다. 혁신의료기기로 지정되면 비급여 또는 선별급여 형태로 수가 청구가 가능하다. 3~5년간 임시 등재 후 임상, 치료 효과 등을 분석해 정식 등재 여부를 결정한다.
혁신의료기기 지정으로 시장 선진입 시도가 활발한 가운데 식약처 디지털의료기기 정식 허가 제품도 늘어나고 있다. 현재 디지털치료제 중 식약처 허가를 받은 제품은 총 9개다. 이중 뉴라이브(이명), 이모코그(경도인지장애), 웰트(섭식장애), 히포티앤씨(우울증) 4개 제품이 올해 허가 받았다.
이처럼 올해 디지털치료제 제도권 진입이 크게 늘어난 것은 국내 기업 기술이 R&D 단계를 지나 상업화에 이른데다 정부의 정책 지원까지 합쳐진 결과다. 2020년부터 디지털치료제 개발이 본격화된 상황에서 4~5년 간 기술개발과 임상시험을 끝내고 상품화로 이어졌다는 분석이다.
여기에 올해 1월부터 디지털의료제품법 시행으로 인공지능(AI) 의료기기, 디지털치료제 등 혁신의료기기 육성 근거를 마련하고, 신속한 시장 진입을 지원한 것도 크게 영향을 미쳤다.
강성지 웰트 대표는 “상대적으로 의약품이나 기존 의료기기와 비교해 디지털치료제는 기술개발과 임상시험 기간이 짧은 편”이라며 “4~5년간의 R&D를 거쳐 올해를 기점으로 디지털치료제 시장 진입이 본격화될 것”이라고 전망했다.
장기적으로 글로벌 경쟁력을 확보하기 위해선 보상체계 개편이 필요하다는 목소리도 나온다. 현재 혁신의료기기 지정에 따른 임시 등재 수가는 대부분 2만~8만원 선이다. 이 금액으로는 R&D 재투자나 수익 창출이 불가능한 만큼 비급여 처방을 선택하고 있는데, 전액 환자 부담인 만큼 확산에 애를 먹고 있다.
디지털치료제 기업 관계자는 “시장 진입을 단축하는 정부 지원은 큰 도움이 되지만 진입 이후 생존을 위한 수가체계 개편은 필수”라며 “최소한의 투자회수나 재투자 여력을 만들기 위해선 수가 현실화가 필요하다”고 지적했다.
정용철 기자 jungyc@etnews.com