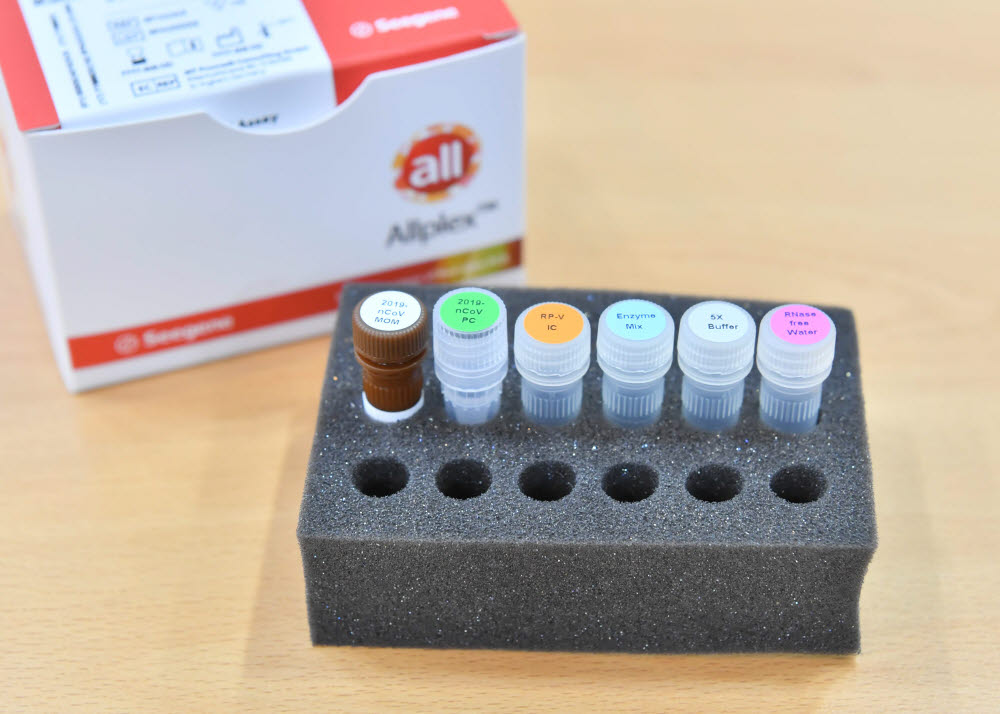
분자진단 전문기업 씨젠(대표 천종윤)은 미국 식품의약국(FDA)이 코로나19 검진을 위한 자사제품 'AllplexTM 2019-nCoV Assay'의 긴급사용을 승인했다고 22일 밝혔다.
코로나19 검진에 세계적으로 사용되고 있는 씨젠 진단시약은 3개 목표유전자(E, RdRp, N) 모두를 검출해내는 특징을 가지고 있기 때문에 정확도가 높을 뿐만 아니라 한 개의 튜브만으로 검사가 가능해 대량검사를 효율적으로 수행할 수 있다.
씨젠은 중국에서 코로나19 사태가 발생한 후 인공지능(AI) 시약개발시스템을 이용해 빠르게 코로나19 진단시약을 개발했다. 씨젠의 관계회사이자 한국 최대검사기관인 씨젠의료재단은 씨젠의 자동화된 검사시스템을 바탕으로 하루 최대 1만5000건 코로나19 검사 역량을 갖추고 있다.
천종윤 씨젠 대표는 “결과분석 소프트웨어(SW)를 포함한 씨젠의 자동화된 시스템은 검사수행의 편리함과 검사물량 확장성으로 지금처럼 수천건의 검사를 하루 만에 수행해야 하는 감염확산 상황에서 검사량을 대폭 증가시키는데 유용한 것으로 입증됐다”고 말했다.
씨젠 검사시스템은 코로나19 검진의 세계적인 표준으로 자리잡으면서 이탈리아, 스페인, 프랑스, 독일 등을 중심으로 60여개 이상 국가에서 사용되고 있다. 이번 FDA 긴급사용 승인을 통해 씨젠은 미국 주요 검진기관이 코로나19 검사를 위해 자사의 자동검사시스템을 통한 대량검사를 진행할 것으로 기대한다.
천 대표는 “최고 분자진단기술을 대표하는 진단시약을 미국에 공급하고 있어 자부심을 느낀다”면서 “계속해서 코로나 바이러스의 수많은 변이까지도 함께 검출할 수 있는 보다 강화된 성능의 제품개선을 준비하고 있다”고 말했다.
정현정기자 iam@etnews.com